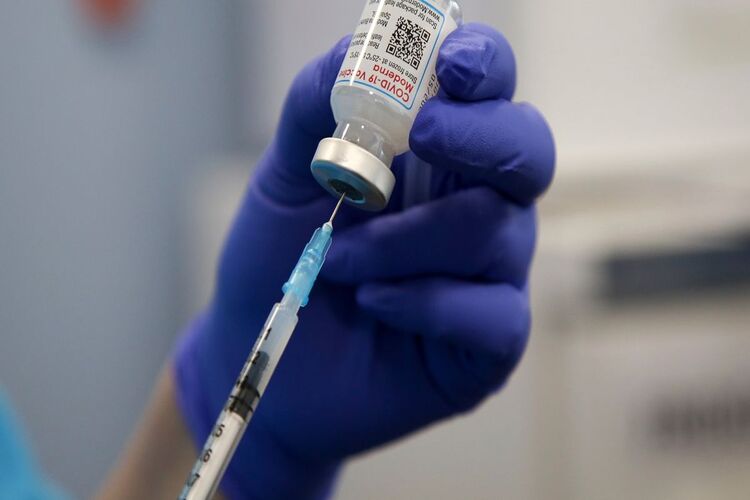
Moderna, Pfizer ขอใบอนุญาต FDA สำหรับวัคซีน Covid-19 ที่ได้รับการปรับปรุง ภาพอาจจะสามารถใช้ได้ในเดือนหน้า
Moderna ได้ยื่นคำร้องต่อสำนักงานคณะกรรมการอาหารและยาแห่งสหรัฐอเมริกาเพื่อขออนุมัติการใช้วัคซีนป้องกันโควิด-19 ที่ปรับปรุงแล้วเพื่อใช้ในกรณีฉุกเฉินในผู้ที่มีอายุ 18 ปีขึ้นไป บริษัทกล่าวในการแถลงข่าวเมื่อวันอังคาร
การเคลื่อนไหวดังกล่าวเกิดขึ้นหนึ่งวันหลังจากไฟเซอร์และ BioNTech ส่งใบสมัคร EUA ของผู้สนับสนุนโควิด-19 ที่อัปเดตสำหรับผู้ที่อายุ 12 ปีขึ้นไป
หากองคการอาหารและยาอนุญาตวัคซีนที่ปรับปรุงแล้ว วัคซีนดังกล่าวอาจวางจำหน่ายในเดือนกันยายน สูตรปรับปรุงของบริษัทเหล่านี้เป็นวัคซีนชนิดไบวาเลนต์ที่รวมวัคซีนดั้งเดิมกับวัคซีนที่กำหนดเป้าหมายสายย่อยของ Omicron BA.4 และ BA.5 ซึ่งปัจจุบันมีอิทธิพลในสหรัฐอเมริกา ช็อตของ Moderna จะได้รับยา 50 ไมโครกรัมและไฟเซอร์เป็นขนาด 30 ไมโครกรัม
Moderna กล่าวเมื่อวันอังคารว่าการทดลองทางคลินิกระยะที่ 2/3 เกี่ยวกับตัวกระตุ้นเหล่านี้กำลังดำเนินการอยู่ ข้อมูลที่ส่งไปยัง FDA มาจากการทดลองในหนูเช่นเดียวกับข้อมูลจากมนุษย์โดยใช้ตัวกระตุ้นที่แตกต่างกันซึ่งได้รับการปรับปรุงเพื่อป้องกันสายพันธุ์ BA.1 ของ Omicron
“เราได้ทำงานอย่างใกล้ชิดกับองค์การอาหารและยาเพื่อให้แน่ใจว่าชาวอเมริกันจะสามารถเข้าถึงตัวกระตุ้นไบวาเลนต์ที่ได้รับการปรับปรุงของ Moderna ซึ่งหากได้รับอนุญาต อาจให้การป้องกันที่สูงกว่า กว้างกว่า และทนทานกว่าต่อ Covid-19 เมื่อเทียบกับตัวกระตุ้นที่ได้รับอนุญาตในปัจจุบัน” กล่าว Stephane Bancel ประธานเจ้าหน้าที่บริหารของ Moderna
จากนั้น FDA จะประเมินข้อมูลจาก Moderna และ Pfizer และตัดสินใจว่าจะอนุญาตให้มีการถ่ายภาพหรือไม่
“องค์การอาหารและยาจะใช้หลักฐานที่มีอยู่ทั้งหมดเพื่ออนุญาตให้ใช้บูสเตอร์ไบวาเลนต์ในฤดูใบไม้ร่วง” โฆษกของ FDA Abigail Capobianco กล่าวในแถลงการณ์ที่ส่งอีเมลถึง CNN เมื่อสัปดาห์ที่แล้ว “มีข้อมูลเกี่ยวกับบุคคลหลายล้านคนที่ได้รับส่วนประกอบต้นแบบเป็นตัวกระตุ้น สำหรับองค์ประกอบ BA.4/5 การรวมกันของข้อมูลที่ไม่ใช่ทางคลินิกที่ได้รับในหนู ข้อมูลจากวัคซีนรุ่นก่อน ๆ (รวมถึงข้อมูลที่เป็นเบต้า เดลต้า และ omicron BA.1) พร้อมด้วยความรู้ที่กว้างขวางของเราเกี่ยวกับความปลอดภัยและประสิทธิภาพของแพลตฟอร์ม mRNA จะถูกนำไปใช้ในการตัดสินใจครั้งนี้”
เมื่อไหร่จะถ่ายได้ผู้ประสานงานการตอบสนองต่อ Covid-19 ของทำเนียบขาว ดร. Ashish Jha ได้กล่าวว่าสารกระตุ้นที่ปรับปรุงแล้วควรจะเผยแพร่ต่อสาธารณชนในช่วงต้นถึงกลางเดือนกันยายน แต่ท้ายที่สุดแล้วจะขึ้นอยู่กับองค์การอาหารและยาว่าเมื่อใดที่กระสุนจะได้รับไฟเขียว
ดร.ปีเตอร์ มาร์คส์ ผู้อำนวยการศูนย์เพื่อการประเมินและวิจัยทางชีววิทยาขององค์การอาหารและยา กล่าวในการให้สัมภาษณ์กับหนังสือพิมพ์นิวยอร์กไทม์สเมื่อวันอังคารว่า หน่วยงานจะไม่เรียกประชุมผู้เชี่ยวชาญด้านวัคซีนอิสระเพื่อขอคำแนะนำว่าจะอนุญาตให้มีการอัพเดทโควิด- 19 นัด.
ติดตามเนื้อหาดีๆ น่าอ่านได้ที่ ahpanama.com อัพเดตทุกสัปดาห์